LEY DE LOS GASES
EL COMPORTAMIENTO DE LOS GASES FRENTE A VARIACIONES DE PRESIÓN Y TEMPERATURA FUE OBJETO DE ESTUDIO DE DIVERSOS CIENTÍFICOS DESDE EL SIGLO XVII. ASÍ SURGIERON LAS DIVERSAS LEYES DE GASES.
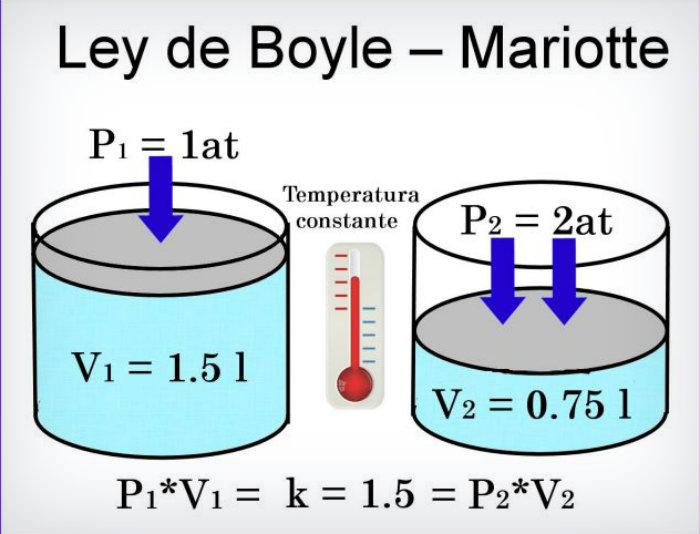
LEY DE BOYLE-MARIOTTE.
Esta ley nos dice que a temperatura constante los volúmenes ocupados por una masa
de gas seco son inversamente proporcionales a la presión que soportan.
Matemáticamente la proporcionalidad que establece la ley puede
expresarse como PxV =K, si se representa en un sistema cartesiano el volumen de un gas en función de la presión el gráfico que se obtiene
es una hipérbola. Los gases no cumplen exactamente esta ley, los que se
suponen que la cumplen se denominan gases ideales o perfectos como por
ejemplo el Helio, que se aproxima a un comportamiento de gas perfecto
siempre que la presión sea baja.
LEY DE CHARLES-GAY-LUSSAC.
La dilatación de los gases con la temperatura fue estudiada en primer lugar por charles (1789), aunque fue GAY-LUSSAC quien mostró que manteniendo la presión constante, el aumento unitario del volumen es proporcional al aumento de temperatura V= KxT
(1802). Como en el caso de Boyle- Mariotte, los gases no siguen
exactamente la primera ley de Gay-Lussac, llamándose gases ideales a los
que siguen ambas leyes.
GRACIAS...:V


Comentarios
Publicar un comentario